Роль персонализированной медицины в восстановлении нарушенных функций региональных физиологических систем
Директор НИО Клинико-фармакологических технологий и персонализированной медицины, заведующий кафедрой клинической фармакологии и пропедевтики внутренних болезней лечебного факультета, академик РАМН

Владимир Кукес
Статьи эксперта
Основные научно-исследовательские работы В.Г. Кукеса носят фундаментально-прикладной характер и посвящены наиболее приоритетным проблемам клинической фармакологии. Впервые в стране им предложено комплексное изучение вопросов клинической фармакологии, включающее исследование фармакокинетики, фармакодинамики, взаимодействия и побочного действия лекарственных средств, разработаны и внедрены методы определения концентрации отечественных и зарубежных лекарственных средств в различных биологических средах организма, доказана необходимость проведения острого лекарственного мониторинга для подбора эффективной и безопасной дозы препарата, прогнозирования его клинического эффекта и риска возможного побочного действия.
Под руководством и непосредственным участии В.Г. Кукеса впервые в стране изучены метаболизм и биоритмология лекарственных средств, методы гено- и- фенотипирования ферментов биотрансформации и их клиническое значение для оптимизации фармакотерапии, молекулярные механизмы взаимодействия лекарственных препаратов, клиническая фармакология блокаторов медленных кальциевых каналов, бета-адреноблокаторов, витаминов в комплексных лекарственных препаратах и биологических жидкостях.
Кукес В.Г., Маринин В.Ф., Белков С.А., Городецкая Г.И., Жестовская А.С.
В ряде случаев оценивая эффективность фармакотерапии мы сталкиваемся со следующими ситуациями: основное заболевание купировано, однако больной чувствует слабость при малейшей физической нагрузке, отдышку; у некоторых повышается уровень сахара, отмечается не стабильное артериальное давление. Что делать врачу? Обвинять больного в симуляции нельзя, поскольку выявляются измененные объективные биохимические показатели. Значит нужно лечить, а что лечить? Казалось, что мы в безвыходном положении, но это не так. Так в чем дело?
Проанализировав соответствующую литературу, ответ оказался простой – мы не достаточно знакомы с работами школы академика Павлова И.П., особенно с работами его учеников наших соотечественников академиков П.К. Анохина и К.В. Судакова (руководители кафедры физиологии 1 ММА им. И.М. Сеченова).
Они установили, что многогранная деятельность нашего организма обеспечивается множеством региональных физиологических систем, которые сопряжены между собой и функционируют по закону обратной связи.
С теоретической точки зрения физиологические региональные системы представляют саморегулирующиеся организации, динамически и избирательно объединенные с ЦНС и периферическими органами и тканями на основе нервной и гуморальной регуляции для достижения приспособительных результатов.
Основная их роль обеспечить нормальное функционирование основных систем организма, при их нарушениях возникающих при многогранной деятельности организма. Они обеспечивают различные потребности организма, прежде всего связанные с метаболическими процессами.
Полезными для организма адаптивными результатами являются в первую очередь обеспечивающие различные стороны метаболических процессов гомеостатические показатели, а также находящиеся за пределами организма результаты поведенческой деятельности, удовлетворяющие различные биологические (метаболические) потребности организма. Таким образом, физиологические региональные системы обеспечиваются, прежде всего, текущими потребностями живых существ. Они постоянно формируются метаболическими процессами.
Но не редко центр регуляции этих систем нарушается и не всегда может обеспечить нормальное состояние функций нашего организма. Однако вследствие различных экстремальных ситуаций, обусловленных нарушением физиологической регуляции или нарушением биохимических равновесий (метаболизма в организме) эти связи нарушаются
Ведущим свойством функциональной системы любого уровня организации является принцип саморегуляции.
При этом взаимодействие функциональных систем в организме осуществляется на основе принципов иерархического доминирования, мультипараметрического и последовательного взаимодействия, системы генеза (созревание функциональных систем и их отдельных частей в процессах пре- и постнатального онтогенеза).
В нормально функционирующем организме действует универсальное правило: общая сумма механизмов, возвращающих отклоненный от оптимального уровня результат, с избытком преобладает над отклоняющими механизмами. При нарушении функции системы наблюдается обратная картина. По отношению к нарушенным системам происходит перестройка деятельности нормальных функциональных систем, причем их активность может быть направлена на ликвидацию нарушенной системы или установление нового компенсаторного уровня меж- и внутрисистемных отношений. Когда деятельность одной из них оказывается нарушенной, тогда другие компенсируют нарушенные функции, обеспечивая в меру возможности оптимальный уровень процессов жизнедеятельности.
При этом деятельности самих нарушенных систем часто утрачивают адаптивное для организма значение и способствуют деструкции организма. Клиническим проявлением деятельности нарушенных систем является формирование патологических синдромов. Поэтому необходимо воздействие на поврежденную систему механизмов лекарственным или иным способом для восстановления функциональной системы. С позиций теории функциональных систем все реабилитационные мероприятия выступают в роли дополнительного внешнего звена саморегуляции, компенсируя тем самым недостаточную функцию тех или иных систем организма.
Однако в отдельных случаях нарушенная система через активацию дефинитивных физиологических функциональных систем может оказывать адаптивное действие на организм, повысив за счет компенсаторной деятельности устойчивость организма к патологическим воздействиям, например, при иммунизации, гипоксии при подъеме в горы и др. [1].
До настоящего времени далеко не обо всех функциональных системах известно в клинической практике. Однако остановимся на том, с какими системами встречаются клиницисты, и разберем некоторые из них.
1.Система обеспечивающая напряжение кислорода в организме. Известно, что оксигемоглобин, поступая в центральный кровоток диссоциирует на кислород и гемоглобин, и напряжение кислорода зависит от скорости и объема этого процесса, который регулируется активной субстанцией – 2,3-дифосфоглицератом. Когда кислорода в крови мало, то концентрация 2,3-ДФГ повышается, в тех случаях, когда кислорода много концентрация 2,3-ДФГ снижается. Но при нарушении метаболизма отмечается нарушение этой связи и часто, особенно при таких синдромах как ХСН, ХОБЛ отмечается снижение 2,3-ДФГ, что приводит к снижению напряжения кислорода и клинически – к развитию синдрома гипоксии. И в этом случае необходимо применять модуляторы этого вещества, которые вызывают активацию и восстанавливают обратную связь. К ним относятся инодий и антиоксидант этоксидол. Применение этих средств нормализует концентрацию 2,3-ДФГ в плазме крови, что способствует нормализации напряжения кислорода.
Нами было установлено влияние Этоксидола на улучшение кислородообмена у пациентов сишемической болезнью сердца и хронической сердечной недостаточностью, путем регуляции процесса гликолиза.
В совместном эксперименте с проф. Воейковым В.В. и Новиковым К.Н. установлено, что при введении этоксидола пациентам с ишемическими повреждениями увеличивается скорость генерации супероксидного анион-радикала в крови, что свидетельствует о повышении активности NADPH–оксидазной иксантиноксидазной систем, которая снижена при ишемических поражениях органов и низком парциальном давление кислорода. При этом происходит активация гликолитических путей образования АТФ. Так у пациентов с ХСН IV ФК увеличивается образование 2,3-ДФГ (до введения 0,23±0,022 г/л крови, после 0,35±0,03 г/л крови) способствующего отделению кислорода от гемоглобина, поступлению его в ткани и как результат, повышение парциального давления кислорода. Снижаются проявления окислительного стресса, посколькув ответ на увеличение генерации О2 - увеличивается и активность СОД дисмутирующей супероксидный анион-радикал, поддерживая стационарную концентрацию О2 - на определённом уровне, защищая тем самым клеточные структуры от его повреждающего действия.
Таблица
Изменение интенсивности ЛЦ-ХЛ цельной крови и параметров окислительно-восстановительных процессов в крови при введении этилметилгидроксипиридин малата (M ±m)
| Курс лечения | Светосумма ЛЦ-ХЛ, имп./300 сек х 103 | Активность СОД, е.а./мг Hb | Общие перекиси мкмоль/мл | МДА,нмоль/мл |
|---|---|---|---|---|
| Пациенты с ХИГМ | ||||
| До лечения | 43,5±10,3 | 8,33±2,53 | 1,22±0,25 | 1,38±0,23 |
| На 6-й день | 103,2±28,3(р =0,029) | 10,41±1,52(р=0,012) | 1,05±0,17(р=0,15) | 1,09±0,21(р=0,016) |
Таким образом, индуцируя указанные оксидазные системы, тесно сопряженные с процессом гликолиза происходит регуляция кислородтранспортной функции крови у больных с ишемическими поражениями.
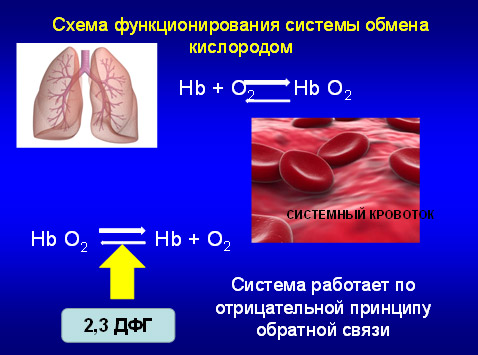
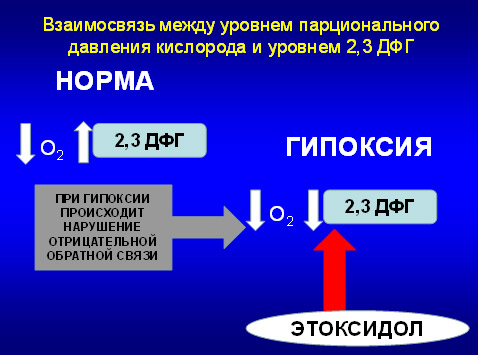
2. Ко второй изучаемой нами региональной физиологической системе относится регуляция углеводного обмена, в литературе получившая название энтероинсулярной оси. В результате обширных исследований этой оси в норме и при таких патологических состояниях, как ожирение и сахарный диабет 2 типа, было показано, что увеличение секреции инсулина происходит под влиянием инкретинов при уровне глюкозы, превышающем 3,8 – 4,0 ммоль/литр. Этот же уровень оказался пороговым и для торможения секреции глюкагона. Таким образом, глюкозозависимая стимуляция инкретинами секреции инсулина и глюкозо же зависимое торможение секреции глюкагона должны в природных условиях обеспечить саморегуляцию углеводного обмена без угрозы гипер или гипогликемии. Гомеостаз глюкозы лежит в основе функционирования организма. Маркеры состояния этой системы: глюкоза, гликоген, HbA1c, инсулин. Среди факторов, регулирующих секрецию инсулина, выделяют разнонаправленное влияние на функцию бета-клеток симпатико-адреналовой системы и стимулирующее глюкозозависимое действие системы инкретинов. Инкретины – энтерогормоны пептидной природы, образующиеся в тонкой кишке в ответ на прием пищи и стимулирующие секрецию инсулина. Они выделяются в кровь в течение суток, но их уровень увеличивается при попадании в кишечник глюкозы и других нутриентов. К инкретинам относятся глюкагоноподобный пептид 1-го типа (ГПП-1 или GLP-1 – glycagon-like peptide-1) и глюкозозависимый инсулинотропный пептид (ГИП или GIP - glucosedependent insulinotropic peptide) [2]. ГИП продуцируется K-клетками, преимущественно расположенными в слизистой оболочке 12-перстной и дистального отдела тощей кишки; ГПП-1 – L-клетками подвздошной кишки. Основная физиологическая функция инкретинов заключается в глюкозозависимой стимуляции секреции инсулина бета-клетками поджелудочной железы. В исследовании на двух здоровых добровольцах было показано, что в ответ на введение одной и той же дозы глюкозы внутривенно и внутрь (в верхний отдел тощей кишки через зонд) во втором случае секреция инсулина была выше. Этот феномен был объяснен как результат дополнительной стимуляции бета-клеток поджелудочной железы инкретинами, чья секреция тощей кишкой стимулировалась попавшей в кишку глюкозой. Феномен был назван «эффектом инкретина». «Инкретиновый эффект» составляет до 60% постпрандиальной секреции инсулина, а у больных СД 2 типа он может быть существенно ослаблен. Рецепторы к ГПП-1 представлены в организме наиболее широко и расположены в различных органах: в островках поджелудочной железы, в печени, желудке, а также в почках, щитовидной железе, легких, головном мозге, скелетных мышцах и сердце [3]. Наряду с общеизвестным фактом нарушения секреции инкретинов и инсулина при ожирении и СД 2-го типа выявлено также снижение экспрессии рецепторов ГИП в b-клетках поджелудочной железы и соответствующее подавление передачи инкретинового сигнала. Этот факт объясняет снижение чувствительности к инкретинам при СД 2-го. Среди эффектов инкретинов можно назвать:
- глюкозозависимую стимуляцию секреции инсулина (ГПП-1 и ГИП). Глюкозозависимость действия заключается в том, что ГПП-1 начинает стимулировать секрецию инсулина бета-клетками только при гликемии, превышающей 3,8 – 4,0 ммоль/л, и прекращает при ее снижении до этого же уровня.;
- утилизацию глюкозы без угрозы гипогликемии (ГПП-1 и ГИП);
- глюкозозависимое торможение секреции глюкагона (ГПП-1);
- замедление эвакуации пищи из желудка и всасывания глюкозы (ГПП-1);
- снижение аппетита и массы тела за счет торможения моторики желудка и центрального анорексигенного эффекта (ГПП-1);
- обеспечение пульсового режима постпрандиальной секреции инсулина (1 раз в 10-15 ми) за счет ритмичного (5-7 раз в час) выделения (ГПП-1). Пульсовой режим необходим для оптимальной регуляции углеводного обмена.
- накопление гликогена в клетках печени, скелетных мышц, сердца (ГПП-1);
- непосредственную или опосредованную нормализацию липидного обмена и липидного спектра (ГПП-1);
- защиту миокарда от ишемического/реперфузионного повреждения (ГПП-1);
- восстановление нарушенных сократимости и диастолической функции левого желудочка (ГПП-1);
- антигипертензивный эффект (ГПП-1);
- протективное воздействие на костную ткань.
Кроме того, в эксперименте на животных было показано, что инкретины (ГПП-1) тормозят апоптоз бета-клеток поджелудочной железы и таким образом способствуют увеличению их пула.[2]. Латентный период секреции ГПП-1 после еды составляет от 5-10 до 15-30 мин. Инкретины метаболизируются ферментами дипептидилпептидазой 4-го типа (ДПП-4) и нейтральными эндопептидазами. Среди разнообразных функций ДПП-4 можно назвать: гидролиз различных пептидов, участие в Т-клеточнозависимых иммунных реакциях, участие в метастазировании. При этом субстратами ДПП-4 служат инкретины (ГПП-1 и ГИП), нейрогормоны (например, СТГ), нейропептид (NP ), хемокины и др. [4]. ГПП-1 и ГИП представляют собой эндогенные физиологические субстраты ДПП-4, концентрация которых прямо связана с активностью ДПП-4. В связи с тем, что период полужизни ГПП-1 и ГИП очень короткий (1-2 мин и около 5 мин, соответственно), использовать их в качестве ЛС в нативном виде нельзя. Для лечения СД 2 применяют аналоги ГПП – 1 и таблетированные ингибиторы ДПП-4 [2], [5].
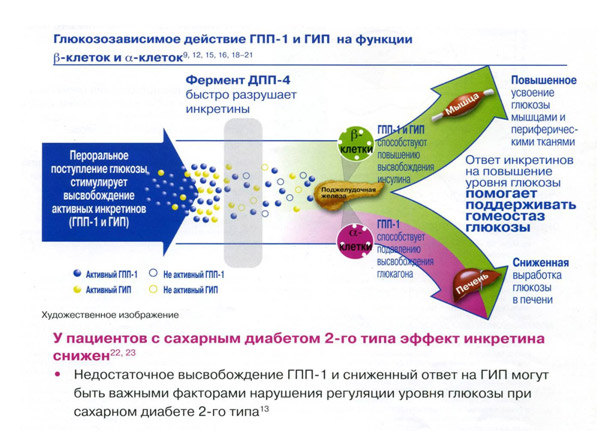
Применение ингибиторов ДПП-4 подавляет активность пиптидаз, сохраняет активность инкретинов, тем самым уровень глюкозы нормализуется. Обратная связь системы восстанавливается.
3. К третьей системе относится система, регулирующая сосудистый тонус. В 1998 году Луи Игнаро Ферид Мьюред и Роберт Фёрчготт – были награждены Нобелевской премией по физиологии и медицине за установление функциональной роли оксида азота в работе сердечно-сосудистой системы. NO образуется в эндотелиальных клетках в процессе трансформации L-аргинина в цитрулин под воздействием NO-синтетазы. Для NO-синтаз характерна регуляция по механизму отрицательной обратной связи – чем выше уровень NO, тем больше снижается активность его синтеза, что обеспечивает локальную регуляцию артериального давления. При снижении АД, наоборот, эндотелий сосудов выбрасывает биологически активное вещество эндотелин-1, который является мощным вазоконстрикторным агентом, что проявляется в резком повышении АД и резистентности к гипотензивным препаратам. В этих случаях наиболее перспективным является использование тех лекарственных препаратов, которые являются донаторами NO групп и позволят восстановить баланс между вазодилятаторами и вазоконтрикторами.
Обратная связь наблюдается также и при регуляции многих жизненно важных субстанций. Так, например, холестерин метаболизируется с образованием гидроксипроизводных, и совместно с холестерином стимулирует его синтез. Таким образом, чтобы подавить синтез холестерина необходимо блокировать его биотрансформацию на различных уровнях его образования.
Соответственно, клиническое изучение физиологических региональных систем, и выявление их механизма действия и регуляции позволяют ставить перед клиническими фармакологами задачу поиска модуляторов действия их регуляторных механизмов, с целью восстановления нарушенных функций. Это и есть четвертый этап развития персонализированной медицины.
- Анохин П. К. Очерки по физиологии функциональных систем. - М.: Медицина, 1974. - 446 с.
- Hansen P., Corbett J. Incretin hormones and insulin sensiti-vity // Trends Endoc. Metab. — 2005. — 16(4). — 135-136.
- Drucker D. Glucagon-like peptides: regulators of cell proliferation, differentiation, and apoptosis // Mol. Endocrinol. — 2003.— 17. — 161-171.
- Золотов Н.Н., Кутепова О.А., Воронина Т.А., Позднев В.Ф., Смирнов Л.Д. и соавт. О возможном участии пептидаз мозга в регуляции функции памяти при старении // ДАН СССР. -1991. -Т. 317, No 1. -С. 234- 237.
- Onge E. S., Miller S. A., Motycka C. Liraglutide (Saxenda ) as a Treatment for Obesity //Food and Nutrition Sciences. – 2016. – Т. 7. – №. 04. – С. 227.
Директор НИО Клинико-фармакологических технологий и персонализированной медицины, заведующий кафедрой клинической фармакологии и пропедевтики внутренних болезней лечебного факультета, академик РАМН

Владимир Кукес
Статьи эксперта
Основные научно-исследовательские работы В.Г. Кукеса носят фундаментально-прикладной характер и посвящены наиболее приоритетным проблемам клинической фармакологии. Впервые в стране им предложено комплексное изучение вопросов клинической фармакологии, включающее исследование фармакокинетики, фармакодинамики, взаимодействия и побочного действия лекарственных средств, разработаны и внедрены методы определения концентрации отечественных и зарубежных лекарственных средств в различных биологических средах организма, доказана необходимость проведения острого лекарственного мониторинга для подбора эффективной и безопасной дозы препарата, прогнозирования его клинического эффекта и риска возможного побочного действия.
Под руководством и непосредственным участии В.Г. Кукеса впервые в стране изучены метаболизм и биоритмология лекарственных средств, методы гено- и- фенотипирования ферментов биотрансформации и их клиническое значение для оптимизации фармакотерапии, молекулярные механизмы взаимодействия лекарственных препаратов, клиническая фармакология блокаторов медленных кальциевых каналов, бета-адреноблокаторов, витаминов в комплексных лекарственных препаратах и биологических жидкостях.












